마이크로바이옴 이야기
마이크로바이옴, 쉽게 이해하기!
마이크로바이옴이 뭔가요?
‘인류 질병 극복의 열쇠’라 불리며, 전 세계 핫이슈로 떠오른 마이크로바이옴(Microbiome)은 미생물을 뜻하는 Microbe와 생태계를 의미하는 Biome의 합성어에요. 쉽게 말해 우리 몸에 살고 있는 모든 미생물의 유전체를 의미해요. 우리가 알고 있는 세균과 바이러스, 곰팡이도 이 마이크로바이옴 구성 중에 하나에요. 세균이라면 전부 몸에 해로운 미생물들이라 생각하셨죠? 사실, 우리 몸에는 좋은 미생물도 많아서 건강에 엄청난 도움을 준답니다.

장내 미생물, 어디에서 무얼 하고 있을까?
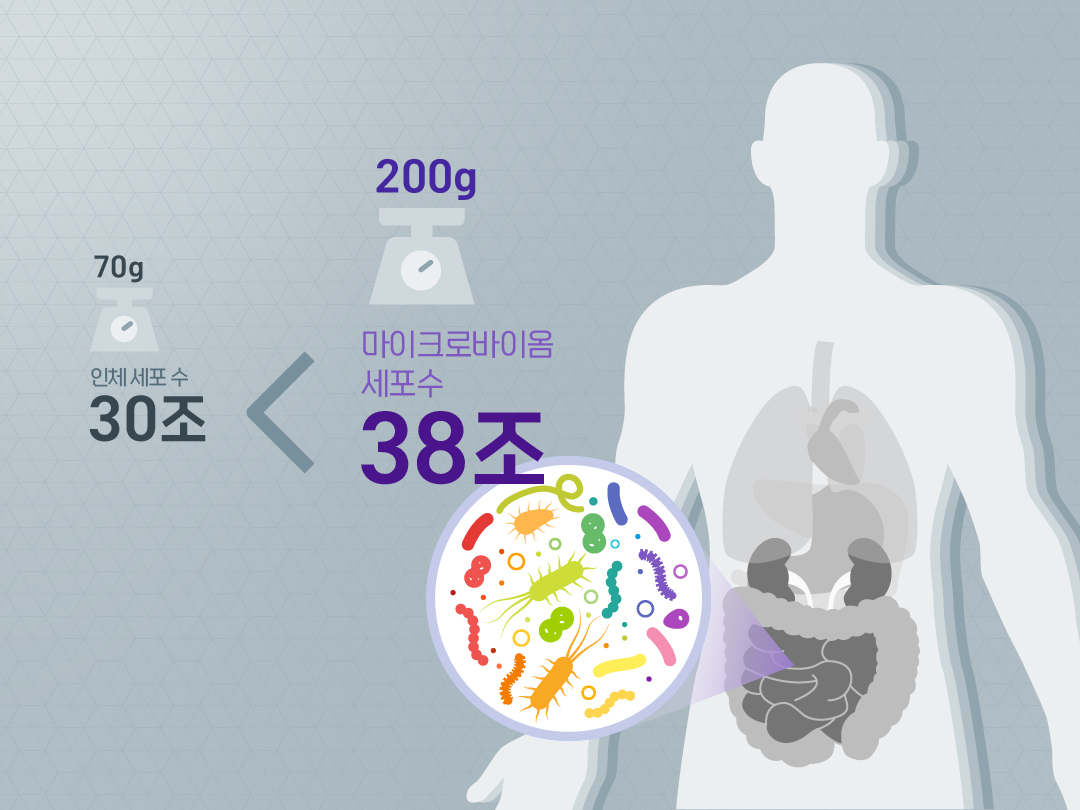
이 미생물들은 인체 어디에 분포되어 있을까요? 입 안과 피부 표면, 질 내부, 위장관 등 다양한데, 그 숫자가 무려 38조 개라고 합니다. 인체 세포 수인 30조 개보다 훨씬 더 많은 숫자랍니다. 그중에서도 대장 속에 가장 많은 양의 미생물들이 존재하고 있습니다. 그 무게만 해도 약 200g! 장내 미생물이 하는 중요한 일들은 아래와 같습니다.
- 첫째, 면역력 강화: 질병 예방을 돕는 든든한 ‘지원군’
- 둘째, 방어 역할: 병원균 침투를 막아주는 ‘보디가드’
- 셋째, 에너지 대사 조절: 짧은사슬지방산(SCFAs) 생성하는 ‘도우미’
- 넷째, 비타민 합성: 우리 몸이 필요로 하는 필수 영양소를 생산하는 ‘조력자’
장내 미생물 생태계를 관리하지 않으면?!
우리 장내 미생물 생태계(=마이크로바이옴)에는 좋은 미생물과 나쁜 미생물이 함께 살며 균형을 이루고 있어야 건강을 유지할 수 있어요. 균형을 유지하면 장 염증을 줄여주는 것뿐 아니라 전신 염증, 심지어 뇌 염증까지도 줄여줍니다. 균형이 깨지면 어떻게 될까요? 나쁜 미생물이 우세해져 염증이 발생합니다. 비만, 당뇨, 우울증 등 다양한 건강 문제의 원인이에요. 장내 미생물의 균형을 지키는 것이 건강의 핵심이에요! 장내 미생물을 잘 관리하려면, 건강한 식단과 생활 습관이 필수입니다.
장내 미생물 생태계가 건강하면 우리 몸도 건강해질 거예요. 지금 바로 시작해 볼까요?
장내 미생물, 면역의 지휘자 그리고 염증의 해결사!
장은 면역 세포의 본부?!
우리 몸의 면역세포 중 약 70%는 장 관련 조직(GALT, Gut-Associated Lymphoid Tissue) 에 모여 있다는 사실, 알고 계셨나요?
장이 음식, 병원균 등 외부 환경과 가장 많이 접촉하는 기관인 만큼, 우리 몸을 지키는 면역 시스템의 주요 거점이 되는 거예요. 여기서 중요한 역할을 하는 것이 바로 장내 미생물입니다. 면역세포가 제 기능을 하지 못하면 면역 체계가 무너져 여러 질병에 취약해지는데 장내 미생물은 면역 세포가 일을 할 수 있게 자극하는 역할을 해요. 면역 세포가 일을 게을리하면 “일 안 하면 큰일 나!”라며 콕콕 찔러 깨워 주기도 하고, 면역세포가 적재적소에서 일을 하도록 지휘하는 역할도 해요.
장내 미생물이 게을러지면?
장내 미생물이 본분을 잊고 게으름을 피우면 우리 몸에 염증이 생길 수 있어요. 염증은 단순한 피로나 불편함을 넘어 만성 피로, 비만, 아토피, 치매와 같은 다양한 건강 문제를 유발할 수 있는 위험 요소입니다. 장내 미생물 생태계를 건강하게 유지하면, 면역 체계는 자연스럽게 제 역할을 잘하게 된답니다. 또한 균형 잡힌 장내 미생물 환경을 유지하면 면역 세포가 바이러스 감염에도 강하게 대응할 수 있어요.
장내 미생물, 대체 못하는 일이 뭐야?
장내 미생물은 우리 몸의 숨은 영웅이에요. 우리 몸 표면이나 내장기관의 내부 표면에는 상피세포가 있어 내장기관을 보호하는 역할을 하는데요. 이 상피세포는 장내 미생물이 만드는 짧은사슬지방산을 먹고 살면서 튼튼한 장벽을 만듭니다. 장벽을 튼튼하게 하는데도 장내 미생물의 역할이 중요한 거죠. 게다가 장내 미생물은 장에서 멀리 떨어진 뇌에도 영향을 끼칩니다. 자폐 스펙트럼 장애, 파킨슨병, 치매뿐만 아니라 우울증도 장내 미생물과 깊은 연관성이 있다고 알려져 있어요. 또한 장내 미생물은 사람이 만들지 못하는 비타민을 만들고, 소화하지 못하는 탄수화물을 분해해서 우리에게 필요한 에너지의 대략 15%를 공급하는 일도 하고 있습니다.
장내 미생물 생태계를 아름답게 가꿔요!
면역력 강화, 염증 완화, 그리고 장과 뇌 건강까지! 장내 미생물은 우리 몸 전반에 걸쳐 큰 역할을 하고 있어요. 오늘부터 균형 잡힌 식단과 건강한 생활 습관으로 장내 미생물 생태계를 돌보는 것, 어떠세요? 건강한 장은 여러분의 몸과 마음을 더 튼튼하게 만들어줄 거예요!

장과 뇌가 연결되어 있다? (Gut-Brain axis)
장과 뇌는 서로 대화를 나눕니다
장에 문제가 생겼을 때 두통이나 기분 저하를 경험한 적이 있나요? 이는 장이 뇌에게 신호를 보내기 때문인데요. 마치 장이 “오늘 기분 안 좋아!”라고 말하면, 뇌가 “너 그러면 나도 우울해!”라고 반응하는 셈입니다. 이런 장과 뇌의 상호작용을 바로 장뇌축 (Gut-Brain Axis)이라고 부릅니다. 영국 옥스퍼드 대학교의 연구에 따르면, 장내 미생물의 다양성이 높을수록 사교적이고 긍정적인 성향을 보이는 반면, 다양성이 낮으면 불안과 스트레스를 더 쉽게 느낀다고 해요.
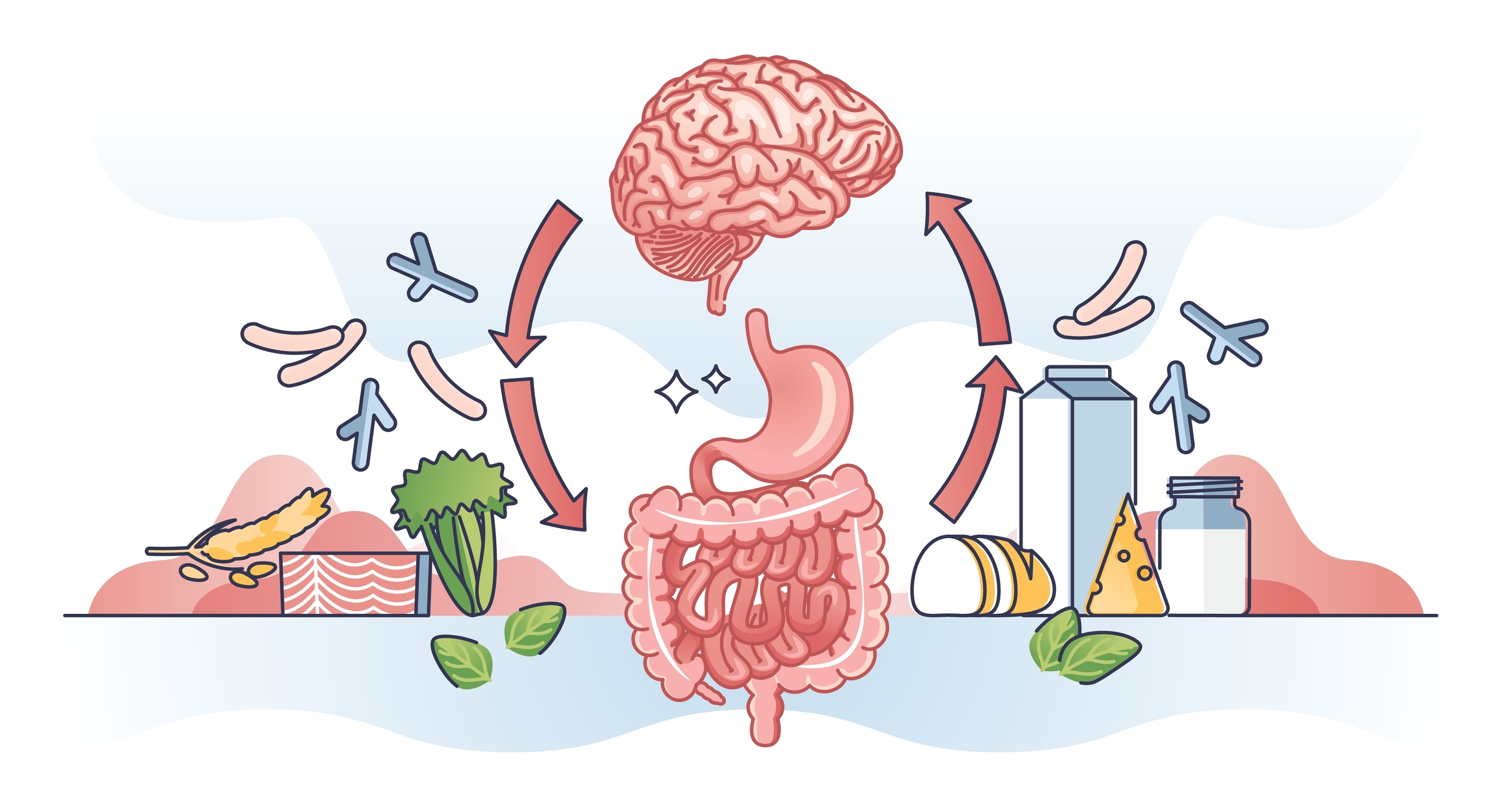

장과 장내 미생물은 멀리 있는 뇌와 어떤 방식으로 소통할까요?
그 비밀은 바로 장과 뇌를 연결하는 ‘고속 통신망’인 미주 신경에 있습니다. 장에서 발생하는 신호의 90% 이상이 뇌로 전달되는데요.
뿐만 아니라, 면역계와 내분비계를 통해서도 연락이 이루어집니다.
- 미주 신경을 통한 소통: 장에서 뇌로 즉각적인 신호 전달
- 면역계를 통한 소통: 장내 미생물은 면역계를 지휘하며 염증 반응을 조절
- 내분비계를 통한 소통: 장내 미생물이 호르몬을 조절
마이크로바이옴(=장내 미생물 생태계)은 우리 면역계를 지휘하는 지휘자입니다. 서구화된 식단으로 마이크로바이옴이 망가지면 면역계를 지휘하는 장내 미생물이 할 일을 잃게 됩니다. 그러면 온몸에 염증이 발생하는데요. 뇌에도 영향을 미치게 되죠. 뇌에 염증이 생기면 면역세포가 우리의 뇌세포를 죽이고 기능도 방해합니다. 그리고 뇌에 여러 문제가 쌓이게 되는데요. 그게 우울감으로 나타날 수 있습니다. 다른 요인과 결합해 치매와 같은 난치성 질병으로도 발전할 수 있어요. 실제로 많은 논문을 통해 치매나 파킨슨병, 자폐스펙트럼 장애 같은 난치성 뇌 질환의 발생 원인 중 하나로 장내 미생물이 지목되고 있습니다.


행복호르몬에도 영향을 미치는 장내 미생물!
마이크로바이옴이 뇌에 영향을 주는 또 하나의 경로는 내분비계입니다. 마이크로바이옴은 우리 몸의 다양한 호르몬을 조절하는 능력을 가지고 있는데요. 그 중 일부가 뇌에 영향을 줍니다. 대표적인 것이 행복 호르몬으로 알려진 ‘세로토닌’이죠. 세로토닌의 약 95%는 장에서 만들어지며, 나머지 5%만 뇌에서 생성됩니다. 그런데 이 세로토닌의 분비를 장내 미생물이 조절한다는 사실, 알고 계셨나요? 전신을 돌아다니는 세로토닌은 우리 장의 운동을 조절하는 등 다양한 역할을 합니다. 아직 정확한 경로는 밝혀지지 않았지만, 세로토닌은 뇌 속 행복감에도 영향을 미친다고 알려져 있습니다. 최근에는 뇌 속 세로토닌 수치를 조절하고, 장에서 세로토닌을 직접 생산하는 장내 미생물들이 발견되었습니다. 장내 마이크로바이옴이 건강하면 우리의 정신적 안정과 행복에도 큰 도움이 된다는 사실이 점점 더 분명해지고 있습니다.
마음과 장이 편안하려면?
결론은 간단합니다. 장내 마이크로바이옴을 잘 가꾸는 것이 곧 뇌와 마음을 건강하게 만드는 지름길이라는 것! 오늘도 장 건강을 위해 다양한 MAC 섭취를 실천해 보세요.
건강한 장이 행복한 뇌를 만듭니다. 지금 바로 시작하세요!
자폐 스펙트럼 장애와 장 건강
자폐 스펙트럼 장애(Autism spectrum disorders, ASD)는 사회적 상호작용의 결핍, 언어성/비언어성의사소통의 문제, 제한적이고 반복적인 행동 패턴으로 특징지어지는 중추 신경계 기반 신경행동 장애입니다. ASD의 유병률은 전례 없이 급격히 증가하고 있으며, 현재 미국에서는 8세 아동 36명 중 1명이 진단받고 있습니다. 그러나 이러한 급증의 원인은 아직 명확히 밝혀지지 않았습니다.
ASD의 원인을 규명하고 효과적인 치료법을 개발하는 데 주요 장애물 중 하나는 이 장애의 기저 메커니즘에 대한 이해 부족입니다. 특히, ASD는 단일 원인에 의한 것이 아니라, 다음과 같은 여러 요인이 복합적으로 작용하는 다면적 질환으로 알려져 있습니다.
- 유전적 요인: 유전자 돌연변이/변형
- 환경적 요인: 출산 요인, 산모의 건강, 화학물질 노출
- 신경 발달 이상: 시냅스 기능 이상, 신경 네트워크 연결 이상, 신경염증
- 호르몬 이상: 세로토닌, 옥시토신 등의 불균형
- 장-뇌 축 이상: 마이크로바이옴, 장 대사물질 불균형
이처럼 ASD는 다양한 원인이 복합적으로 작용하기 때문에 증상과 중증도가 개인마다 다르게 나타나며, 이로 인해 진단과 치료가 어렵습니다. 또한, ASD 환자는 종종 신경발달 장애, 정신 건강 문제, 소화기 및 면역 질환 등의 동반 질환을 가지고 있어 증상이 더 복잡해지고 진단 및 치료 과정이 더욱 까다로워질 수 있습니다.
ASD와 위장 질환
ASD와 동반 질환 중에서 위장 문제는 가장 흔한 문제 중 하나로 꼽힙니다. ASD는 신경발달 장애인 만큼, 중추 신경계(CNS)의 발달에 영향을 미치는 요인들이 장신경계(ENS)의 발달 및 기능에도 영향을 미칠 가능성이 높습니다. 이로 인해 장 운동성 및 감각 기능 문제와 같은 위장관 이상이 발생할 수 있으며, 이는 변비, 설사, 복통 등의 문제로 이어질 수 있습니다. 1943년 미국 존스홉킨스 대학의 아동 정신과 의사 Leo Kanner가 자폐증, autism이라는 병명을 처음으로 하면서 ASD와 위장 문제 간의 연관성을 언급했습니다. 그는 사회적 상호작용이 제한되고 강박적 행동을 보이는 11명의 아동 중 절반 이상이 섭식 문제(음식을 섭취하는 과정에서 발생하는 문제)를 가지고 있음을 관찰했습니다. 당시 카너는 이러한 음식 선호 문제를 ASD의 핵심 증상으로 보았지만, 위장관 기능 이상 때문이라고 생각하지는 않았습니다. 이후 수십 년 동안 ASD와 위장 문제 간의 관계를 평가하는 연구는 제한적이었으나, 최근 연구들에서는 ASD 환자에서 위장 장애의 높은 유병률이 반복적으로 보고되었습니다. 14,000명을 대상으로 한 한 연구에서는 ASD 환자가 장 질환으로 병원을 방문할 위험이 일반 환자보다 2~3배 높다고 보고했습니다. ASD 환자에게 흔히 나타나는 위장 문제는 다음과 같습니다:
- 복통
- 기능성 설사(특별한 기질적 원인 없이 발생하는 설사)
- 기능성 변비(특별한 기질적 원인 없이 발생하는 변비)
- 위식도 역류 질환(GERD)
- 특정 음식이나 질감에 대한 선택적 섭식
특히, 기능성 변비는 ASD 환자에서 가장 흔한 문제로 반복적으로 보고되고 있습니다.
위장 문제는 ASD의 핵심 증상을 악화시키는 데 강한 연관성을 보입니다. 위장 증상은 사회적 위축, 표현 언어의 퇴행, 과민성, 공격성, 불안, 반복적 행동 및 강박적 행동 등 다양한 행동 문제와 연관될 수 있습니다. 예를 들어, 항정신병 약물인 리스페리돈(Risperidone)은 위장 문제가 없는 ASD 환자보다 위장 문제가 있는 환자에서 효과가 낮은 것으로 나타났습니다.


(표)ASD와 연관된 장 질환: 기능성 변비/설사, 위 식도 역류, 선택적 취식, 복통, 복부 팽만/가스
ASD의 핵심 진단 증상: 사회적 상호작용 장애, 의사소통 장애, 반복적인 움직임
위장 문제와 연관된 행동 및 정신과적 동반 질환: 과민성/공격성, 인지 장애, 강박 행동
(표)ASD와 연관된 장 질환: 기능성 변비/설사, 위 식도 역류, 선택적 취식, 복통, 복부 팽만/가스
ASD의 핵심 진단 증상: 사회적 상호작용 장애, 의사소통 장애, 반복적인 움직임
위장 문제와 연관된 행동 및 정신과적 동반 질환: 과민성/공격성, 인지 장애, 강박 행동
ASD와 장내 마이크로바이옴
고대의 히포크라테스는 기원전 약 400년에 "모든 질병은 장에서 시작한다"고 주장했으나, ASD와 장내 미생물군 간의 연관성에 대한 본격적인 연구는 수천 년 후에 이루어졌습니다. 1990년대, 한 아이의 어머니인 Ellen Bolte는 회귀성 ASD와 설사 증상을 보이는 아들이 클로스트리디움(Clostridium)이 생성하는 신경독소로 인해 ASD 관련 행동 및 위장 문제가 발생한다고 가설을 세웠습니다. 이후 소아 위장병 전문의 Robert Sandler는 클로스트리디움을 표적으로 하는 비흡수성 항생제인 반코마이신을 사용하여 치료를 진행했습니다. 놀랍게도, 반코마이신 치료 후 Bolte의 아들은 행동 문제와 설사 증상에서 상당한 개선을 보였습니다. 이를 기반으로 Sandler는 회귀성 ASD와 설사를 가진 11명의 아이들을 대상으로 연구를 진행했으며, 그 결과 10명의 아이들이 위장 문제와 신경심리학적 평가에서 개선을 보였습니다. 그러나 항생제 중단 후 몇 주 이내에 증상이 재발했습니다. 이는 항생제를 통한 장내 미생물군의 선택적 제거가 일부 ASD 관련 위장 및 행동 증상을 조절할 가능성을 시사합니다. 최근 연구에서는 클로스트리디움과 같은 Clostridiales 계열의 종 증가가 염증성 사이토카인(IL-6, IL-1, IL-17, IFNγ) 및 ASD와 연관된 트립토판과 세로토닌 수치와 관련이 있음을 밝혀냈습니다. 장내 미생물군, 위장관, 뇌 사이의 상호작용을 연구하는 미생물군-장-뇌 축(Microbiota-Gut-Brain Axis)이 ASD와 관련된 특성에 미치는 영향을 다룬 연구가 급증하고 있습니다. 무균 쥐(germ-free mice)에 대한 연구에서 장내 미생물군이 인지, 감정, 기분 및 신경 기능에 중요한 CNS 영역의 발달에 영향을 준다는 사실이 밝혀졌습니다. 무균 수컷 쥐에서 해마(hippocampus)의 세로토닌성 뉴런 수가 증가하고 뇌유래신경영양인자(Brain-derived neurotrophic factor, BDNF) 수치가 감소하는 반면, 전두엽 피질(prefrontal cortex)의 수초 형성(myelination) 이상 및 편도체(amygdala)의 신경 세포의 수상돌기(dendrite) 비대를 보입니다. 이러한 이상은 고정된 행동, 언어 발달 지연, 사회성 결핍 및 인지 장애와 관련이 있습니다. 중요한 점은 일부 CNS 결핍 및 행동 문제가 Bifidobacterium과 같은 인간 미생물 이식, 프로바이오틱스 투여, 혹은 정상 쥐와의 동거를 통한 장내 미생물 이식으로 회복될 수 있다는 것입니다. 장내 미생물 이식(Fecal Microbiota Transplantation, FMT)은 장-뇌 축 기능 장애와 관련된 질환의 치료 가능성을 제시했습니다. ASD 환자의 장내 미생물군을 무균 쥐에 이식한 결과, 사회적 결핍 및 반복적 행동과 같은 핵심 ASD 관련 행동 증상이 유발되었습니다. 이 쥐들은 또한 ASD 관련 유전자(Fmr1, Nrxn2m, Ube3a 등)의 유전자 조절 메커니즘이 변화되었으며, 타우린 및 5-아미노발레르산과 같은 미생물 대사산물이 감소했습니다. 이 대사산물을 ASD 증상이 나타난 쥐에 투여했을 때, 행동 개선이 관찰되었습니다. 또한, 모체 미생물군 전이가 ASD 발달에 미치는 영향을 다룬 연구에서도, ASD 아동과 그 어머니 간 유사한 미생물군 프로파일이 발견되었습니다. 이는 특정 장내 미생물 결핍이 ASD 관련 행동과 연관되어 있으며, 모체의 장내 미생물군이 자녀의 ASD 발달에 영향을 미칠 수 있음을 시사합니다. Mazmanian 연구팀은 ASD와 관련된 불안 및 과민성에 p-크레솔(p-cresol)과 같은 미생물 대사산물이 역할을 할 수 있음을 발견했습니다. 연구에 따르면, 4-에틸페닐황산염(4-EPS) 수치가 ASD 환자에서 높게 나타났으며, 무균 쥐에서는 관찰되지 않았습니다. Bacteroides ovatus와 Lactobacillus plantarum 같은 특정 박테리아가 4-EPS와 그 전구체를 생성하며, 이는 편도체 및 해마의 기능적 연결에 영향을 미쳐 불안 유발 행동을 초래했습니다. 연구팀은 이를 바탕으로 AB-2004라는 페놀 화합물을 장에서 격리하는 약물을 이용해 임상 시험을 진행했습니다. 8주간 AB-2004를 투여받은 ASD 환자 26명은 소변 및 혈액에서 4-EPS 수치 감소, 기능적 MRI에서 편도체와 전측 대상피질 간의 연결성 변화, 그리고 과민성 및 불안 증상의 개선을 보였습니다.
장신경계(ENS)와 장내 마이크로바이옴
ASD 환자에서 주로 진단되는 위장 문제는 장 운동 장애(변비 또는 설사) 및 내장 통증과 관련이 있으며, 장내 마이크로바이옴이 장 운동성과 내장 통증 조절에 영향을 미친다는 사실은 여러 연구를 통해 반복적으로 입증되었습니다. 장내 마이크로바이옴이 결여된 무균 쥐에서는 장신경 세포 수가 감소하고, 장신경 세포 타입(감각, 운동, 분비, 혈관 신경세포 등)별 분포가 변화하는 등 ENS 발달에 이상이 발생합니다. 또한 내장 고유 감각 뉴런의 흥분성이 감소하여 장 연동 운동과 장–뇌 신경 신호 전달 경로에 이상이 생깁니다. 무균 쥐는 내장 과민성도 보이는데, 이는 대장 팽창에 대한 과도한 내장 운동 반응으로 나타납니다. 이 과정은 척수에서 Toll-유사 수용체 및 사이토카인 유전자 발현 증가와 연관되며, 통증 처리에 관여하는 전측 대상회 피질(anterior cingulate cortex) 및 중뇌 수도관 주위 회백질(periaqueductal gray)의 이상을 동반합니다. ENS는 대부분 태아기에 발달하지만, 장 신경 회로는 청소년기 및 성인기에도 계속 발달합니다. 특히, 장내 마이크로바이옴은 출생 후 ENS의 가소성과 기능을 조절하는 중요한 요소로 작용합니다. 항생제 치료를 통해 장내 마이크로바이옴이 변화할 경우, 장 운동성, 장 신경 회로, 내장 통증이 변화를 겪는 것으로 나타났습니다. 프랑스 낭트 대학의 Michel Neunlist 교수 연구에 따르면, 항생제 처리 후 FMT를 시행한 결과, 짧은 사슬 지방산(SCFA) 및 담즙산 생산이 증가하고, 장 상피 투과성 감소와 함께 염증성 사이토카인(IL-1β, TNF) 발현 감소가 관찰되었습니다. 또한, ASD 성인의 대변 추출물을 무균 쥐에 주입했을 때, 신경 및 신경교 세포 마커(Synapsin 1, Tubulin β3, S100B, GFAP) 발현에 변화가 나타났습니다. 미국 스탠포드 대학의 Justin Sonnenburg 교수 연구에 따르면, ENS 회로의 기능은 생애 전반에 걸쳐 조절 가능하며, 이러한 조절은 장내 미생물군에 크게 의존할 수 있습니다. 연구 결과, 성인 무균 쥐에서 장내 미생물군을 회복시켰을 때 장 통과 시간 감소, 신경 흥분성 회복, 내장 통증 민감도 감소, 그리고 장 신경 및 신경교 세포 밀도 정상화가 관찰되었습니다. 스위스 베른 대학의 Andrew J. Macpherson 교수와 영국 프랜시스 크릭 연구소의 공동 연구에서는 프로바이오틱스 또는 특정 박테리아 균주를 투여했을 때, 장내 미생물군 회복과 유사한 효과가 나타나는 사실이 확인되었습니다.
장내 마이크로바이옴과 ENS, CNS와 ASD
ASD의 대표적인 동물 모델인 BTBR 쥐는 사회적 행동 결핍 및 반복적 행동과 같은 ASD 유사 행동을 보이기 때문에 ASD 연구에서 널리 활용되고 있습니다. 특히, 이 쥐는 인간 ASD 환자와 유사한 특정 장내 박테리아 비율 변화 패턴을 나타냅니다. 아일랜드 John Cryan 교수 연구에 따르면, Blautia 생균제를 처리한 BTBR 쥐에서 사회적 행동, 반복 행동, 불안 유사 행동이 개선되었으며, 시상하부에서 옥시토신과 아르기닌 바소프레신 유전자 발현이 증가한 것으로 보고되었습니다.
ASD와 위장 문제의 공통된 위험 요인: 유전적 요소
ASD와 ASD와 연관된 위장 문제는 공통된 유전적 원인에서 비롯된다고 알려져 있습니다. 독일 하이델베르크대학 Gudrun Rappold 교수 연구팀은 Simons Foundation for Autism Research Initiative (SFARI) 유전자 데이터베이스를 활용해 ASD 관련 유전자를 분석한 결과, 고위험 ASD 유전자의 90% 이상이 말초 조직에서도 발현된다는 사실을 밝혔습니다. 특히, 최고 순위 ASD 위험 유전자 62개 중 90% 이상이 뇌와 위장 조직 모두에서 발현되며, 이들 유전자는 장신경계(ENS) 발달에도 기여하는 것으로 나타났습니다. 이는 ASD 위험 유전자가 신경 발달뿐만 아니라 장내 기능과 장신경계 발달에도 영향을 미친다는 것을 시사합니다. ASD와 관련된 가장 신뢰도 높은 위험 유전자 중 하나로 꼽히는 CHD8 유전자는 장 및 신경 발달에 중요한 역할을 합니다. CHD8 변이를 가진 사람들은 변비를 자주 겪는 것으로 보고되었으며, CHD8 유전자 손실은 신경 세포 성장과 축삭 형성에 문제를 일으켜 신경 발달 장애를 유발합니다. 이로 인해 언어 및 인지 발달 지연 등의 증상이 나타날 수 있습니다. 또한, CHD8 유전자의 돌연변이는 대장의 장신경 전구체 감소를 초래해 장 신경세포 발육 부전, 장 운동성 저하, 장내 고세로토닌혈증을 유발합니다. 실제로 ASD 환자의 약 3분의 1에서 고세로토닌혈증이 관찰되며, 이는 세로토닌이 장 신경계에서 신경 발생을 유도하고 다양한 신경세포 아형의 비율을 조절하며, 위장관 운동성, 상피 투과성, 장세포 증식 등에 영향을 미치기 때문입니다. 중국 충칭의 소아 건강 및 질환 국가 임상 연구 센터 연구에 따르면, ASD 환자의 대변을 이식받은 무균 쥐가 ASD 관련 행동 표현형을 보였으며, 장 및 뇌에서 세로토닌 대사 이상이 나타났습니다. 이는 장내 미생물과 뇌-장 축 간의 연관성을 더욱 뒷받침하는 결과로 볼 수 있습니다.
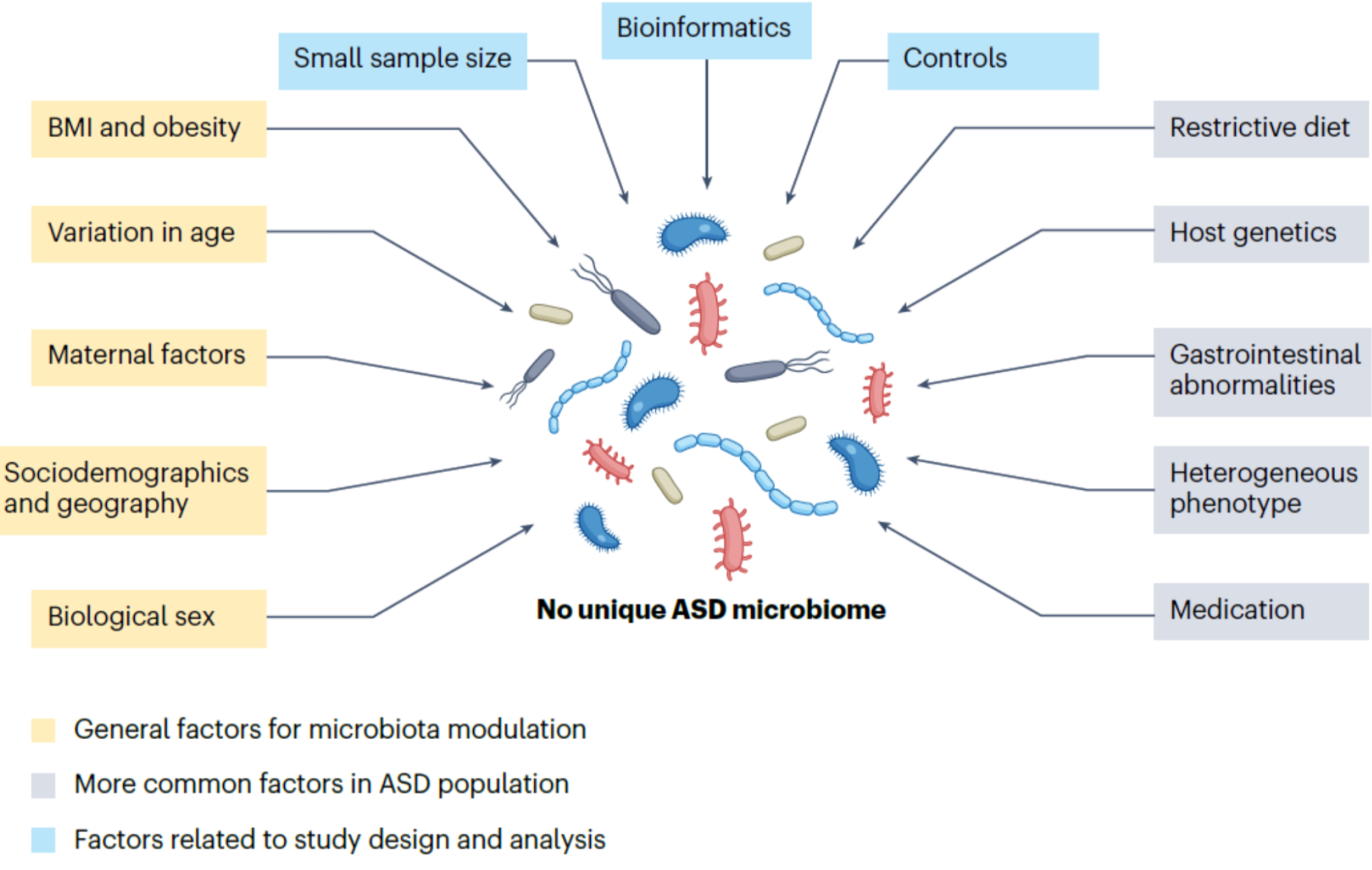

(그림) ASD에서 장내 미생물군 다양성에 영향을 미치는 여러 혼재 변수들
(그림) ASD에서 장내 미생물군 다양성에 영향을 미치는 여러 혼재 변수들
ASD의 복잡한 이질성과 함께, 여러 변수들이 ASD 환자의 장내 미생물군 구성에 영향을 미칩니다. 이들 변수는 신경 기능이 정상인 사람들에서 관찰되는 요인과 유사하거나 독특할 수 있습니다.
1. ASD 환자에게 고유한 변수들 (회색 박스)
- 제한된 식단(restrictive diets): ASD 환자들은 식단이 제한적일 수 있으며, 특정 음식을 피하는 경향이 높습니다. 이는 장내 미생물군의 다양성에 영향을 미칩니다.
- 광범위한 약물 치료(pharmacotherapy) 및 영양 보충제 사용: ASD 환자들은 약물과 보충제에 많이 노출되며, 이는 장내 환경에 변화를 일으킬 수 있습니다.
- 유전적 이상: 특정 ASD 환자들은 유전자 변이를 가지고 있어, 장내 미생물군에 영향을 줄 수 있습니다.
- 다양한 동반 질환: ASD는 위장 문제를 포함한 여러 의학적 및 정신적 동반 질환을 동반할 수 있어, 장내 미생물군의 복잡성을 증가시킵니다.
2. 장내 미생물군 변화에 영향을 미치는 일반적인 요인 (노란색 박스)
- 생물학적 성별: 남성과 여성의 성별 차이는 장내 미생물군 구성에 영향을 미칠 수 있습니다.
- 인구 통계학적 다양성(demographic diversity): 인종 및 지역에 따른 차이가 장내 미생물군에 영향을 미칠 수 있습니다.
- 연령(age): 연령대에 따라 장내 미생물군이 다르게 변화합니다.
- 모체 요인(maternal factors): 임신 중 모체의 건강 상태와 식단이 자녀의 장내 미생물군에 영향을 미칠 수 있습니다.
- 체질량 지수(BMI): BMI가 높거나 낮은 경우 장내 미생물군에 변화를 일으킬 수 있습니다.
ASD와 위장 문제의 공통된 위험 요인: 환경적 요소
ASD는 유전적 변이에 의해 발생할 수 있지만, 환경적 요인이 유전적 취약성을 유발할 수 있기 때문에 ASD 병태생리에 있어 환경적 위험 요인의 역할을 이해하는 것이 중요합니다. 모체의 스트레스, 감염, 고지방 식단 및 비만과 같은 요인들은 ASD와 연관될 수 있으며, 특히 모체의 장내 미생물군이 이러한 노출과 ASD 발달 간의 연결 고리일 가능성이 있다는 연구가 점차 밝혀지고 있습니다.
모체 비만과 신경 발달 이상 간의 연관성은 다수의 연구를 통해 확인되었습니다. 임신 중 모체의 비만, 과도한 체중 증가, 대사 질환 등은 태아 발달에 중요한 영향을 미치며, 모체 비만은 자녀의 ASD 발달 위험을 1.5배 증가시키는 것으로 알려져 있습니다. 동물 모델을 활용한 연구에서는 모체의 고지방 식단이 새끼의 CNS 발달에 영향을 주어, 새끼가 탐색, 언어 기반, 인지, 그리고 고정된 행동에서 ASD와 유사한 표현형을 보였습니다. 이와 함께 시상하부의 옥시토신 발현 뉴런에도 변화가 관찰되었습니다. 특히, 이들의 장내 마이크로바이옴에서 Lactobacillus reuteri 수치가 현저히 감소했습니다. 그러나 L. reuteri 보충을 받은 새끼 쥐들은 뇌 및 행동 표현형이 정상화되었습니다. 이 효과는 유전적 및 환경적 요인을 조절한 ASD 모델에서도 반복적으로 재현되었으며, L. reuteri가 CNS에서 옥시토신 합성을 증가시켜 뇌 기능을 정상화하는 것으로 추정됩니다.
모체 염증 또한 자녀의 ASD 발달에 주요한 위험 요인으로 작용할 수 있습니다. 바이러스 또는 세균 감염이나 7일 이상 지속된 발열은 ASD 발병 위험을 최대 3배까지 증가시킬 수 있다는 연구 결과가 보고되었습니다. 또한, 모체가 자가면역 질환을 앓고 있는 경우 자녀의 ASD 발달 위험이 25% 증가한다는 임상 연구 결과와, 핀란드의 코호트 연구에서는 임신 초기에 모체의 C-반응성 단백질(CRP) 수치가 높은 경우 자녀의 ASD 발병 위험이 43% 증가한다는 보고가 있습니다.
동물 모델 연구에서는 모체 면역 활성화(MIA) 쥐 모델에서 자녀가 사회적 상호작용과 의사소통에서 ASD와 유사한 행동 결함을 보였습니다. 이들 쥐는 CNS와 장 내막 투과성이 증가했으며, 장내 Clostridia, Bacteroides, Lachnospiraceae 균총의 변화가 동반되었습니다. 특히 Bacteroides fragilis 보충제를 통해 장 투과성과 ASD 관련 행동이 정상화되었으며, 혈청 내 인돌 피루브산(indole pyruvate)과 4-에틸페닐황산염(4-EPS) 수치가 감소했습니다. 이는 장 점막 장벽 복구와 관련될 가능성이 있습니다. 또한, IL-17 매개 염증 반응은 태반 염증, 신경병리, 그리고 ASD 유사 행동과 연관될 수 있습니다. IL-17 유도 기능이 알려진 분절 필라멘트 박테리아(segmentous filament bacteria)와 같은 모체 장내 미생물군은 이러한 염증 반응을 유도하여 ENS(장신경계) 및 CNS 발달에 영향을 미칠 수 있습니다.
IL-6는 염증성 장질환과 같은 만성 염증성 및 자가면역 질환에서 주요한 역할을 하며, ASD 환자의 경우 지능 및 사회화 지표와 역상관 관계를 보입니다. IL-6 수치의 증가는 장 상피 투과성 증가 및 조밀 결합 단백질 감소와 같은 장벽 기능 약화와 연관이 있으며, 이는 ASD 표현형과 연결될 수 있습니다. IL-6 매개 염증은 태반 염증과도 연관될 수 있습니다. MIA 동물 모델에서 IL-6를 선택적으로 제거한 경우, 자녀의 ASD 관련 표현형이 예방된 것으로 나타났습니다. 특정 장내 미생물군은 IL-6 조절에 영향을 미쳐 장-뇌 축을 통해 염증이 신경 발달 및 행동 문제를 유발할 수 있습니다. 4-EPS는 장내 미생물군에 의해 생성되며, ASD와 관련된 불안 및 과민성 표현형을 유발하는 것으로 밝혀졌습니다. 이는 특정 미생물군 조절이 ASD 증상 개선에 기여할 수 있음을 시사합니다.
발프로산(Valproic Acid)은 항간질제로 사용되지만, 임신 중 노출 시 자녀의 ASD 발병 위험을 증가시킬 수 있다는 연구 결과가 있습니다. 다수의 연구에서는 발프로산 노출이 ASD와 유사한 표현형 및 위장 문제와 연관되어 있음을 밝혀냈습니다. 모체가 발프로산에 노출된 경우 자녀의 장 운동성이 저하되고 점막 기능이 약화되었으며, 장내 마이크로바이옴 조성이 변화했습니다. 그러나 건강한 마이크로바이옴을 이식한 경우 세로토닌 및 글루타메이트 신호 경로가 개선되었고, ASD 관련 행동 또한 개선되었습니다.
장내 마이크로바이옴-뇌 축 활용한 ASD 치료: 장내미생물 이식
최근 연구에 따르면 장내 미생물군이 ASD(자폐 스펙트럼 장애)와 연관된 중추 신경계(CNS) 및 장신경계(ENS)의 기능에 중요한 역할을 한다는 사실이 밝혀졌습니다. 이를 바탕으로 증상 관리의 한계를 극복하기 위한 새로운 치료법이 개발되고 있습니다. 현재 ASD의 주요 증상이나 동반 질환을 효과적으로 치료할 수 있는 방법이 부족한 상황에서, 장내 미생물군 조절을 통한 치료법이 주목받고 있습니다. 대표적인 접근법으로는 프리바이오틱스, 프로바이오틱스, 장내 미생물 이식(FMT), 식이 요법 등이 연구되고 있습니다. 특히 장내 미생물 이식은 기존에 Clostridioides difficile 감염 치료에서 효과가 입증되었으며, 최근 ASD 치료 가능성도 검토되고 있습니다. 미국 애리조나 주립대학의 Rosa Krajmalnik-Brown 교수 연구팀은 ASD 아동 18명을 대상으로 2주간 반코마이신 치료 후 10주간 장내 미생물 이식을 진행했습니다. 연구 결과, 이식 후 2주 이내에 위장 및 행동 증상이 개선되었으며, 이 효과는 최대 24개월 동안 지속되었습니다. 또한, 중국 충칭 Daping 병원의 연구에서는 ASD 아동 40명을 대상으로 장내 미생물 이식이 위장 및 행동 증상을 개선했음을 확인했습니다. 이 연구에서는 세로토닌, γ-아미노부티르산(GABA), 도파민 수치의 변화와 함께 장내 미생물 구성이 정상 신경 발달 아동과 유사한 형태로 회복되었습니다. 특히 Eubacterium coprostanoligenes의 초기 높은 비율은 위장 증상 악화와 관련이 있었으며, 이식 후 해당 균의 감소가 행동, 감정, 언어 및 위장 문제 개선과 연관되었습니다.
장내 마이크로바이옴-뇌 축 활용한 ASD 치료: 프리바이오틱스, 프로바이오틱스
프로바이오틱스는 건강에 유익한 살아있는 미생물로, 다양한 위장 질환 치료를 위해 연구되고 있습니다. 특히 과민성 대장 증후군(IBS)과 같은 장-뇌 상호작용 질환에서 유의미한 개선 효과가 보고되었습니다. ASD 관련 프로바이오틱스 연구는 아직 초기 단계이지만, 긍정적인 초기 결과들이 도출되고 있습니다. 다양한 연구에 따르면 특정 프로바이오틱스가 ASD의 행동 증상을 개선할 수 있으며, 여러 균주를 포함한 복합 제제가 더 효과적일 수 있습니다. 이탈리아 피사대학의 Sara Calderoni 교수 연구에서는 ASD와 위장 문제가 있는 약 100명의 아동을 대상으로 한 연구에서, 프로바이오틱스 치료가 장 기능 및 감각 문제를 개선했음을 확인했습니다. ASD 진단 척도(ADOS) 및 바이넬랜드 적응 행동 척도에서 긍정적인 변화가 관찰되었으며, 이는 행동 개선이 위장 문제 해결에 따른 2차 효과일 수 있음을 시사합니다. 또한 모체 면역 활성화(MIA) 동물 모델에서 Bacteroides fragilis 보충은 의사소통, 고정 행동, 불안 및 감각 운동 결핍을 개선했으며, Lactobacillus reuteri는 사회적 행동 개선 효과를 보였습니다. 국내에서는 SB-121이라는 L. reuteri 기반 제제가 성인 ASD를 대상으로 한 임상 1상 시험에서 사회적 선호도 및 적응 행동 개선을 확인했습니다. 프리바이오틱스는 특정 프로바이오틱스의 성장을 촉진하는 물질로, 프룩탄, 갈락토스, 전분, 포도당, 펙틴 유래 올리고당 등이 이에 해당합니다. 임상 연구에 따르면 프리바이오틱스만으로도 장내 미생물군을 건강한 상태로 전환시키고, 장 기능 개선, 염증성 사이토카인 감소, ASD 관련 과민성 및 사회적 결핍 완화에 도움이 된다고 보고되었습니다. 프리바이오틱스와 프로바이오틱스를 함께 사용하는 **신바이오틱스(synbiotics)**가 더 큰 상승 효과를 낼 수 있다는 연구도 있습니다. 캐나다 캘거리 대학의 Raylene Reimer 교수 연구에서는 ASD 동물 모델에서 L. reuteri 단독 또는 프리바이오틱 올리고프럭토스와 함께 사용했을 때, 장 투과성 개선 및 사회적 행동, 반복 행동, 자기 손질 행동 개선이 확인되었습니다.
장내 마이크로바이옴-뇌 축 활용한 ASD 치료: 식단
식단(diet) 은 장내 미생물군 구성을 가장 크게 변화시킬 수 있는 요소로, 장 기능 조절에 중요한 역할을 합니다. 특히, 식단 다양성이 제한적인 경우가 많은 자폐 스펙트럼 장애(ASD) 환자들에게도 큰 영향을 미칠 수 있습니다. 한 연구에서는 ASD 아동 99명, ASD가 없는 형제 51명, 신경전형 아동 97명(대조군)**을 대상으로 식단 다양성, 장내 미생물군 구성 및 대변 상태 간의 연관성을 평가했습니다. 호주 퀸즐랜드 대학의 Jacob Gratten 교수가 약 250명의 어린이를 대상으로 수행한 임상 연구에서는 위장 증상과 식단 다양성 감소 사이의 강한 연관성이 확인되었습니다. 특히, ASD 그룹에서 관찰된 식단 제한성은 장내 미생물군의 낮은 다양성과 묽은 대변 간의 상관관계를 보여주었습니다. 배제식(Exclusion-based diet)은 특정 음식을 제외함으로써 증상을 완화하려는 식단으로 ASD 환자를 대상으로 보통 글루텐-프리(gluten-free) 및 카제인-프리(casein-free, GFCF) 식단, 글루텐-프리 및 케톤 생성 식단이 일반적으로 사용되며, 행동이 개선된 사례들은 보고되고 있으나 아직 일관된 과학적 증거는 부족합니다. 글루텐-프리 및 카제인-프리 식단(GFCF)은 ASD 환자들 사이에서 인기를 끌었지만, 현재까지 ASD 환자들이 셀리악병, 밀 알레르기 또는 우유 알레르기에 더 많이 노출된다는 증거는 없습니다. 오피오이드 과잉 이론(Opioid Excess Theory)에서 시작된 GFCF 식단은, 글루텐 및 카제인 소화 불량이 장벽 투과성을 증가시키고, 이로 인해 오피오이드 유사 물질이 생성되어 뇌 기능에 영향을 미친다는 가설에 기반합니다. 초기 연구에서 ASD 아동의 소변에서 글루텐 및 카제인 유래 오피오이드 수치가 증가한 것으로 보고되었지만, 이후 연구에서는 일관되게 재현되지 않았습니다. 또한, 소변 내 펩타이드 수치와 장 투과성 간의 상관관계도 발견되지 않았습니다. 케톤 생성(Ketogenic) 식단은 1920년대부터 간질 치료에 사용되었으며, 특히 ASD와 연관된 발작 치료에서도 활용되고 있습니다. 소규모 사례 연구에서는 케톤 생성 식단이 ASD 환자의 사회성 및 탐색 행동을 개선했다고 보고되었습니다. 여러 ASD 동물 모델에서 케톤 생성 식단이 발작과 사회성 문제를 개선하는 것으로 나타났습니다. 장내 미생물군에 큰 변화를 유발하는 것으로 알려져 있지만, 기능적 연구는 부족합니다. ASD 환자에서 미토콘드리아 기능 장애가 보고된 바 있으며, 동물 모델을 통해 케톤 생성 식단이 미토콘드리아 기능을 회복시키는 효과가 확인되었습니다. 하지만 케톤 생성 식단은 변비와 같은 다양한 위장 문제를 유발할 수 있습니다. 이로 인해 ASD 환자에게 적용할 때 주의가 필요합니다.
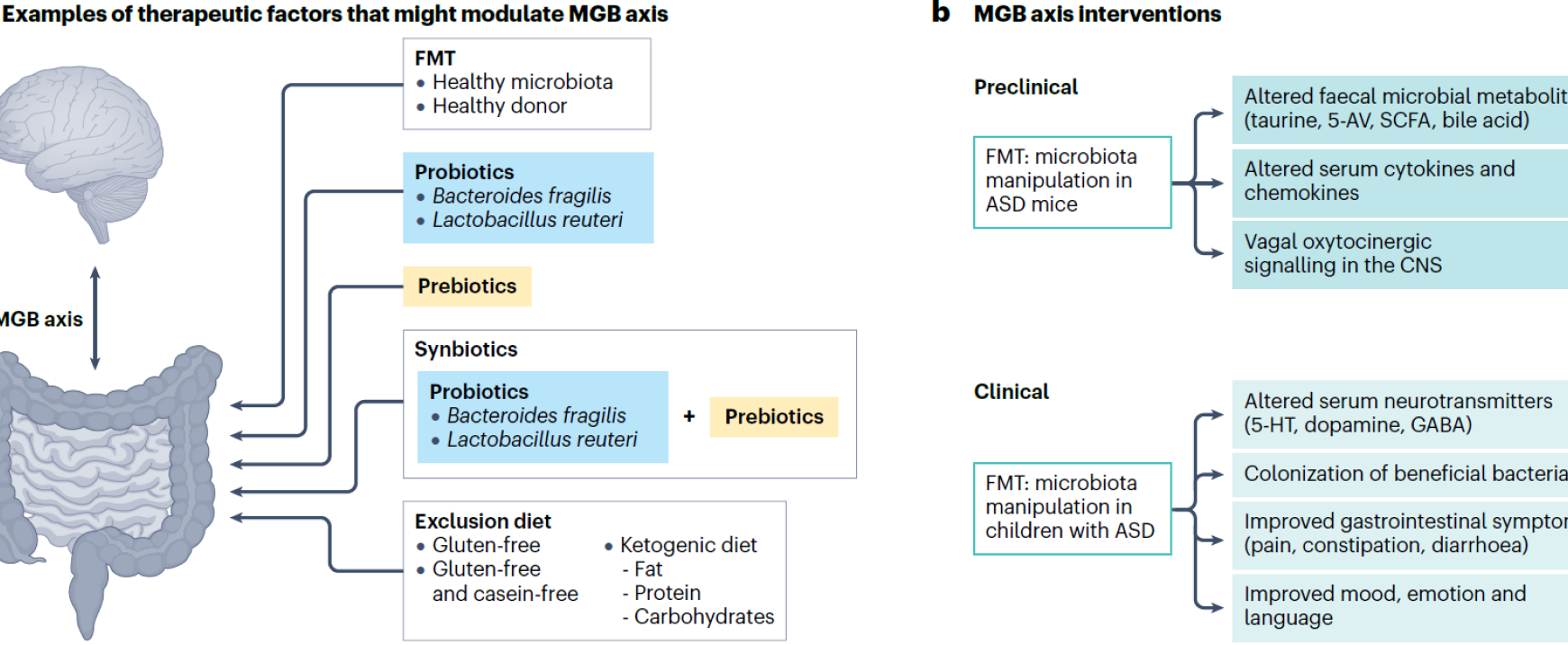

(그림) ASD에서 장-뇌 축(MGB axis) 활용을 통한 치료 및 기전적 타겟
(그림) ASD에서 장-뇌 축(MGB axis) 활용을 통한 치료 및 기전적 타겟
장내 미생물군 조절은 ASD 증상 개선을 위한 잠재적인 치료 전략으로 주목받고 있습니다. 장-뇌 축(MGB axis)을 타겟팅하는 다양한 방법들이 연구되고 있으며, 행동 증상 및 위장 문제를 개선하기 위한 접근이 시도되고 있습니다.
1. 장내 미생물군을 타겟으로 한 치료 전략 (패널 a)
- 장내 미생물 이식(FMT)
- 프로바이오틱스, 프리바이오틱스 및 신바이오틱스:
- 배제식(exclusion diets):
2. 장-뇌 축 조절을 통한 ASD 증상 개선 기전:
- 박테리아 대사산물(예: 단쇄지방산, SCFA 및 5-아미노발레르산(5-AV))
- 염증성 사이토카인
- 옥시토신-도파민 신호 경로
ASD는 단순히 중추 신경계의 행동적 진단 기준을 넘어서는 복잡한 질환임이 널리 인정되고 있습니다. 이러한 복잡성은 다양한 동반 질환들로 인해 더욱 두드러지며, 그중에서도 위장 질환은 특히 주목받고 있습니다. ASD 환자들은 위장 문제의 유무, 약물 사용, 식이 제한 등에서 큰 개인차를 보이며, 증상 개선을 위한 뚜렷한 방법이 아직 확립되지 않았습니다. 따라서, 일관된 치료법이나 단순한 프로바이오틱스, 프리바이오틱스, 식단 개선보다는, 개개인의 증상을 정의하고 맞춤형 개선 방법을 찾는 접근이 중요합니다.
참고문헌
Nature Reviews Gastroenterology & Hepatology, 2024, 21(3):142-163.
맥(MAC)? 나를 위한 음식이 아닌 장내 미생물의 음식!
맥(MAC)이란 무엇인가요?
맥(MAC, Microbiota-Accessible Carbohydrates)은 우리가 먹는 음식이 아니라 ‘장내 미생물의 ‘먹이’입니다. 마이크로바이옴과 건강에 대해 알아가다 보면 자주 듣게 되는 용어인데요. 맥(MAC)은 식품에 포함된 복합 탄수화물로, 밀가루나 쌀에 들어 있는 전분과는 달리 우리 소화액으로는 분해되지 않습니다. 대신 대장까지 도달해 장내 미생물의 에너지원이 됩니다. 장내미생물은 이 소화되지 않은 맥(MAC)을 먹고, 우리 몸에 유익한 짧은사슬지방산(Short-Chain Fatty Acids)을 만들어냅니다. 흥미로운 점은, 어떤 장내 미생물이냐에 따라 먹을 수 있는 MAC의 종류가 다르다는 사실! 가령, 어떤 미생물은 사과의 펙틴을 먹고, 또 다른 미생물은 보리의 베타글루칸을 먹습니다. 따라서 다양한 식이섬유를 적절히 조합해서 섭취하는 것이 장내 미생물의 다양성을 유지하는 핵심입니다.
장내 미생물을 굶기면 어떤 일이 생길까요?
만약 장내 미생물에게 맥(MAC)을 공급하지 않으면 어떻게 될까요? 먹이를 찾지 못한 장내 미생물은 장의 점막을 갉아먹기 시작합니다. 점막이 미생물의 먹이로 사용되면 장 점막이 손상되어 장누수증후군(Leaky Gut Syndrome)이 발생할 수 있습니다. 또한 장내 손상으로 세균 독소가 혈액으로 퍼지면 전신 염증을 유발할 위험도 있습니다. 참고로, 맥(MAC)과 비슷한 개념으로 프리바이오틱스(Prebiotics)가 있습니다. 하지만 프리바이오틱스는 특정 유산균만을 위한 먹이라는 점에서 모든 장내 미생물을 위한 맥(MAC)과는 차이가 있습니다.
장내 미생물 건강을 위한 ‘반반 식탁’
장과 장내 마이크로바이옴 건강을 위해 일주일에 최소 30가지 이상의 과일, 채소, 곡물, 견과류 등을 통해 맥(MAC)을 섭취하는 것을 권장합니다. 이를 위해 ‘반반 식탁’을 꾸리는 것을 추천합니다.
반반식탁이란?
- 식사의 절반은 우리가 평소에 먹는 음식으로
- 나머지 절반은 장내 미생물들이 먹을 수 있는 맥(MAC)으로 채우는 것
이렇게 하면 우리도 맛있게 먹고, 장내 미생물도 충분히 먹이를 얻어 건강한 균형을 유지할 수 있습니다. 나를 위한 음식 50%, 장내 미생물을 위한 맥(MAC) 50%! 지금부터 장과 마이크로바이옴을 위해 다양한 MAC이 풍부한 식단을 시작해 보세요.
장내 미생물이 행복하면 우리 몸과 마음도 더 건강해질 수 있습니다!















